ISRS
Los antidepresivos podrían estar actuando de maneras antes desconocidas
Los ISRS y la ketamina se unen directamente a un receptor de BDNF llamado TrkB, según un estudio.
17 de marzo de 2021 Revisado por Lybi Ma
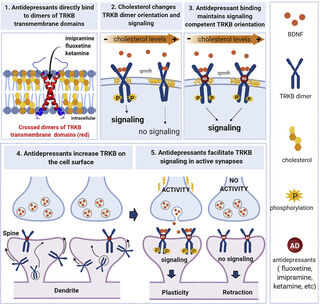
Puntos clave: Un nuevo estudio desafía las nociones que se tenían anteriormente sobre cómo funcionan los antidepresivos. Esta investigación sugiere que los ISRS de acción lenta y la ketamina de acción rápida se unen directamente a un receptor del factor neurotrófico derivado del cerebro (BDNF) y promueven la plasticidad neuronal que alivia la depresión sin la ayuda de la serotonina o el glutamato.
Un nuevo estudio internacional (Casarotto et al., 2021) dirigido en colaboración por el autor principal Eero Castrén del Centro de Neurociencia de la Universidad de Helsinki junto con colegas del Departamento de Física investiga cómo tres medicamentos antidepresivos diferentes: fluoxetina (un ISRS que se vende bajo la marca Prozac), imipramina (un antidepresivo tricíclico) y ketamina de acción rápida (una nueva "terapia revolucionaria" para la depresión resistente al tratamiento; disponible solo en un consultorio médico o clínica certificada): interactúan con un receptor BDNF conocido como TrkB. Este artículo de acceso abierto se publicó el 18 de febrero en la revista revisada por pares Cell.
Históricamente, se pensaba que los efectos de los inhibidores selectivos de la recaptación de serotonina (ISRS) y de los antidepresivos tricíclicos tenían su origen en su capacidad para mantener más serotonina y noradrenalina disponibles para el cerebro al aumentar los niveles de estos neurotransmisores en la brecha sináptica. En esta misma línea, se pensaba que el efecto antidepresivo de la ketamina funcionaba principalmente inhibiendo los receptores de glutamato.
En particular, los tres medicamentos antidepresivos examinados en este estudio (fluoxetina, imipramina y ketamina) interactuaron con TrkB sin aumentar o inhibir necesariamente otros neurotransmisores como la serotonina, la norepinefrina o el glutamato.
Aunque investigaciones anteriores han identificado un vínculo entre los antidepresivos que aumentan los factores neurotróficos como el BDNF, que desempeñan un papel en la regulación de la neuroplasticidad, hasta ahora, los investigadores pensaban que los fármacos antidepresivos actuaban sobre el BDNF indirectamente a través de los receptores de glutamato y serotonina. Este estudio es potencialmente innovador porque muestra que los antidepresivos desencadenan la unión directa a los receptores BDNF.
"Encontramos que todos los antidepresivos estimulan la señalización del BDNF al unirse a su receptor TrkB", dijo Castrén en un comunicado de prensa. "Esta señalización es necesaria para los efectos celulares y conductuales de los antidepresivos en nuestros modelos experimentales. Los efectos de los antidepresivos sobre la plasticidad [neuronal] no requieren, por lo tanto, aumentos en los niveles de serotonina o la inhibición de los receptores de glutamato, como se pensaba anteriormente".
"Estudios anteriores han demostrado que en la terapia con ISRS, los fármacos alcanzan gradualmente la alta concentración cerebral necesaria para unirse al receptor TrkB, mientras que la ketamina y la esketamina administradas por vía intravenosa como un aerosol nasal [es decir, Spravato] alcanzan el nivel necesario para unirse rápidamente, en un cuestión de minutos", agregó Castrén. "La diferencia en el inicio de acción de los ISRS y la ketamina puede deberse a su diferente capacidad para alcanzar en el cerebro la concentración necesaria para unirse a los receptores TrkB".
El modelado molecular realizado por el grupo de investigación del Departamento de Física de Ilpo Vattulainen como parte de este estudio identificó "el sitio de unión de los antidepresivos en la región transmembrana de TrkB" y demostró “que la estructura de TrkB es sensible a la concentración de colesterol de la membrana celular". La creación de mutaciones del motivo de unión al antidepresivo TrkB tanto in vitro como in vivo "alteraron las respuestas celulares, conductuales y que promueven la plasticidad a los antidepresivos".
Puntos destacados de este estudio:
- Varios antidepresivos, incluidos los ISRS y la ketamina, se unen directamente a TrkB.
- La unión del antidepresivo a TrkB facilita la acción del BDNF y promueve la plasticidad neuronal.
- La mutación puntual en la región transmembrana de TrkB bloquea los efectos de los fármacos antidepresivos.
Aunque los antidepresivos como la fluoxetina (Prozac) y la sertralina (Zoloft) se denominaron "inhibidores selectivos de la recaptación de serotonina" poco después de su aprobación por la FDA a fines de la década de 1980, principios de la de 1990, un creciente cuerpo de evidencia del siglo XXI sugiere que estos medicamentos antidepresivos funcionan únicamente aumentando los niveles de serotonina en el cerebro; es más complicado que eso. Según la evidencia acumulada, se podría especular que la nomenclatura de los ISRS no describe con precisión cómo funcionan estos antidepresivos y puede ser un nombre inapropiado.
El BDNF tiene vínculos con la plasticidad neuronal inducida por antidepresivos y la "euforia del corredor"
Desde principios de la década de 2000, los investigadores han sabido que los fármacos antidepresivos y el ejercicio aeróbico promueven la plasticidad neuronal y la neurogénesis (nacimiento de nuevas neuronas). Al igual que estudios recientes (Gökçe et al., 2019) han investigado la correlación entre un aumento del BDNF inducido por el ejercicio y un menor riesgo de trastornos depresivos mayores, otros estudios han investigado cómo la eficacia de los antidepresivos puede estar vinculada al BDNF. (Consulta "Por qué el ejercicio aeróbico es milagroso para el cerebro").
El año pasado, investigadores del Laboratorio de Neurociencia Molecular y Celular de la Universidad Rockefeller (Chottekalapanda et al., 2020) identificaron cómo una vía molecular que involucra a la proteína activadora-1 (AP-1) facilita una reacción en cadena que "activa varios genes que promueven la plasticidad neuronal y remodelación, permitiendo al cerebro revertir el daño neurológico asociado con la depresión". Según los autores: "Después de dos o tres semanas, los efectos regenerativos de esos cambios se pueden ver y sentir". Esta investigación sobre antidepresivos ayudó a explicar por qué los ISRS tardan unos 14 días en activarse.
La última investigación de Casarotto et al. (2021) también ayuda a explicar por qué los ISRS tienden a ser de acción lenta. Y por qué, por el contrario, la ketamina tiene un efecto rápido y puede aliviar los síntomas depresivos en cuestión de minutos. "Los fármacos ISRS se unen a la proteína transportadora de serotonina con mucha más avidez que al TrkB, pero la unión de la ketamina al receptor de glutamato y TrkB se produce en concentraciones de fármaco similares", señalan los autores.
El autor principal, Plinio Casarotto, investigador postdoctoral en el Centro de Neurociencia de la UH, y los coautores resumen: "Los presentes hallazgos demuestran que los antidepresivos se unen al TrkB y aumentan alostéricamente la señalización del BDNF, vinculando así directamente los efectos de los antidepresivos con la plasticidad neuronal".
"La plasticidad inducida por antidepresivos es utilizada por la actividad neuronal específica de la red para guiar el recableado de las redes plásticas, lo que permite una readaptación beneficiosa de las redes cableadas anormalmente durante el desarrollo o por estrés (Castrén, 2013)", y concluyen: "Nuestros datos sugieren un marco que une los efectos de todos los antidepresivos con la orientación mediada por la terapia para lograr la respuesta clínica al antidepresivo".
Abstracto gráfico (Casarotto et al., 2021) del ensayo celular de acceso abierto "Los fármacos antidepresivos actúan uniéndose directamente a los receptores de neurotrofina TRKB" (CC BY 4.0)
A version of this article originally appeared in English.


